2025年12月04日,中国药科大学附属南京天印山医院成功举办了“AST-3424 用于既往接受过含免疫检查点抑制剂系统治疗失败进展的 AKR1C3 高表达的晚期肝细胞癌的有效性和安全性的随机、阳性药平行对照、全国多中心的 Ⅱb 期临床研究” 启动会。本次会议由国际国内知名肿瘤临床研究专家秦叔逵教授与机构办公室主任陈映霞教授共同主持,申办方浙江海正药业股份有限公司医学团队、CRO 诺思格 (北京) 医药科技股份有限公司团队、主要研究者寻琛主任团队、临床试验机构管理人员及相关科室研究人员共同参会,深入研讨试验方案细节,凝聚执行共识,为晚期肝细胞癌患者带来精准治疗新希望。

本项临床试验由南京天印山医院和复旦大学附属中山医院共同担任组长单位,复旦大学附属中山医院樊嘉院士和秦叔逵教授共同担任Leading PI。秦叔逵教授在致辞中指出,当前免疫检查点抑制剂已成为晚期肝细胞癌治疗的重要手段,但多数患者接受治疗后仍会面临疾病进展,且尚无后线标准治疗方案,临床亟需创新药物突破治疗困境。AST-3424 的靶点选择精准契合肝癌发病机制,前期临床数据显示出优异的疗效与安全性优势,有望为晚期肝细胞癌的后线治疗提供新的突破。
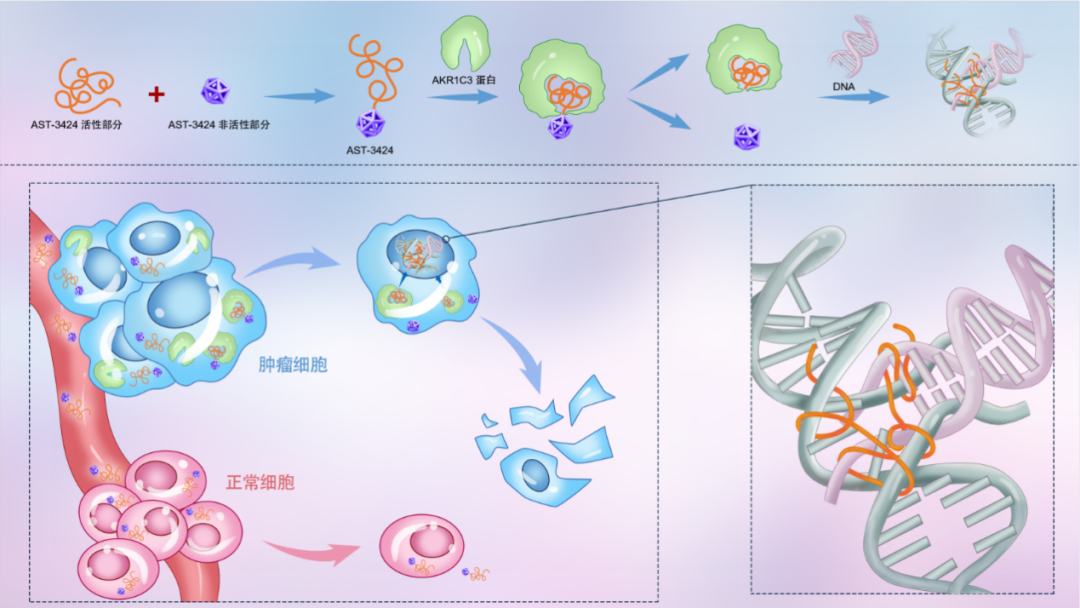
AST-3424 作为全球首创的小分子偶联药物(SMDC),以AKR1C3为核心靶点,采用前药设计—在AKR1C3 高表达的肿瘤微环境中选择性裂解为具有细胞毒性的双链 DNA 烷化剂 AST-2660,实现对肿瘤细胞的精准杀伤,而正常组织因 AKR1C3 低表达几乎不受影响,体现了 “靶向富集、精准抗癌” 的独特优势。前期临床研究数据表明,AST-3424 的不良反应导致停药的TRAE发生率仅3.3%,毒性谱以可控的血液学毒性为主。Ⅱ期临床试验(n=30)显示,在既往接受多线治疗的患者中,AST-3424组中位OS为10.8个月,展现出具极佳的治疗潜力。

会议期间,各方团队围绕试验核心内容展开系统研讨:
1.试验方案与设计:明确目标人群为 AKR1C3 高表达(细胞质/细胞核2 + 及以上比例≥70%)的晚期肝细胞癌患者,采用 2:2:1 随机分组设计,以9个月总生存率为主要终点,全面评估药物有效性与安全性;
2.关键执行细节:重点梳理了入排标准审核要点、剂量调整原则、合并用药管控、生物样本采集与处理规范;
3.质量与安全管理:明确不良事件(AE)、严重不良事件(SAE)的报告流程及时限,强调试验药物的接收、保存、发放、配制、输注及回收销毁等全流程管理要求;
4.GCP 合规要求:规范研究者职责、知情同意流程、原始数据记录与溯源标准,确保试验过程科学规范、数据真实可靠。

陈映霞主任总结指出,本项研究是 AST-3424 迈向临床的关键一步。我院作为牵头单位,也是首家启动的医院,研究团队将认真学习方案,细化执行流程,加强各方协同配合,全力保障受试者权益,确保研究数据的科学性与完整性,力争早日为晚期肝癌治疗提供更多精准治疗方案,助力肝癌治疗领域的发展与革新。
素材来源:沈明雪 张如梦
编辑:吴文祺
审核:陈映霞