2024年6月14日, CDE官网发布《药物临床试验不良事件相关性评价技术指导原则(试行)》。本指导原则制定目的是进一步规范我国药物临床试验中AE与试验药物相关性评价方法与标准,为药物临床试验申办者、研究者、监管机构及其他相关人员开展药物临床试验中不良反应的监测、识别、评估与控制相关工作提供参考,以更好地践行临床试验风险最小化,保护受试者安全。
一、为何需构建药物临床试验安全信息监测评估体系?
自2018年加入ICH以来,我国一直全面执行ICH E2A《临床安全性数据管理:快速报告的定义和标准》和相关技术要求。此外,随着2019年《药品管理法》、2020年《药品注册管理办法》以及2021年我国首部《药物警戒质量管理规范》的发布,对药物临床试验中的安全风险监控、评估、分析与控制提出了更明确的要求。这些法规明确了申办者的责任主体,强调了在临床试验过程中不断完善安全性研究、监测评估和风险评估的重要性,以实现临床试验风险最小化,切实保障受试者安全。
目前,我国亟需进一步规范和细化临床试验AE与试验药物相关性评价的技术要求和标准。尤其是对于一些中小企业或初创公司的申办方,它们缺乏风险评估相关经验和完善健全的技术体系,且目前国际上尚无统一、公认的关于临床试验AE与药物相关性评价方法与标准,实际工作中,常采用各种分类方法与标准,用于描述相关性结果的分类名称也多种多样,不利于临床试验各相关方科学、规范、高效地开展药物临床安全性研究、评价与风险管理,最终可能会导致对受试者健康安全的危害。因此,进一步构建、统一、规范我国药物临床试验安全信息监测评估体系具有重要意义。
二、《药物临床试验不良事件相关性评价技术指导原则》有哪些亮点?
1. 明确了制定目的、技术范围、适用对象
该指导原则在国内为首次制定,国外也无相应指南或指导原则可供参考,本指导原则明确了制定目的、技术范围、适用对象:

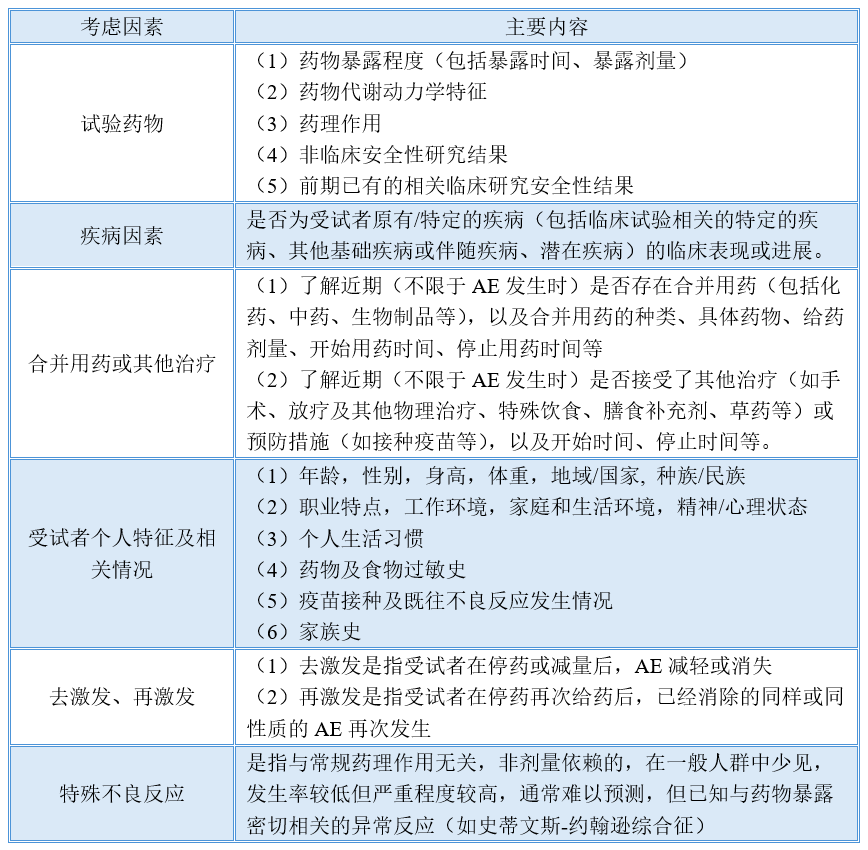
2. 明确了药物临床试验AE相关性评价中需要考虑的各种因素
准确评价临床试验AE与试验药物的相关性,可能受到多方面因素的影响和制约,因此,对AE进行准确可靠的相关性评价要从多方面因素考虑,进而作出科学、合理、准确的判断。
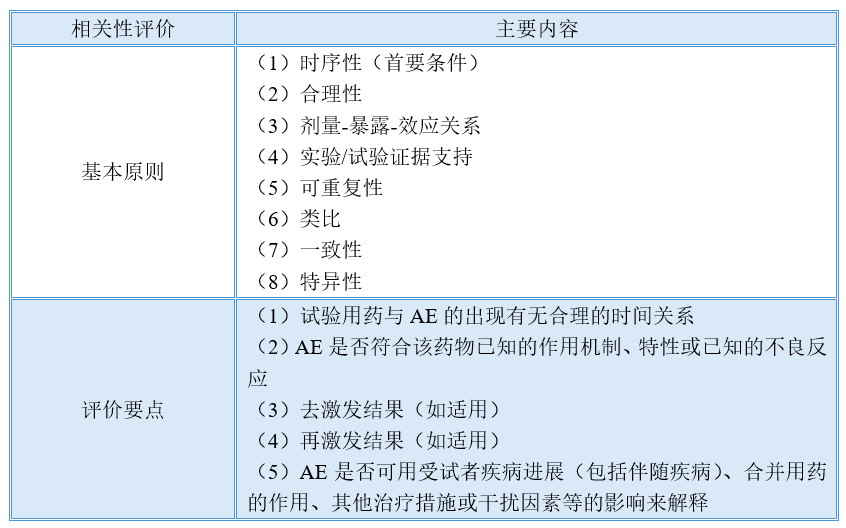
3. 制定了药物临床试验不良事件相关性评价的基本原则与评价要点
在药物临床安全性研究中,个例AE与试验药物相关性判断是药物不良反应整体评估的基础和重要依据。对于每一个个例AE均需科学、客观、准确评估,并在此基础上,根据情况采取必要的风险控制措施,保护受试者安全。
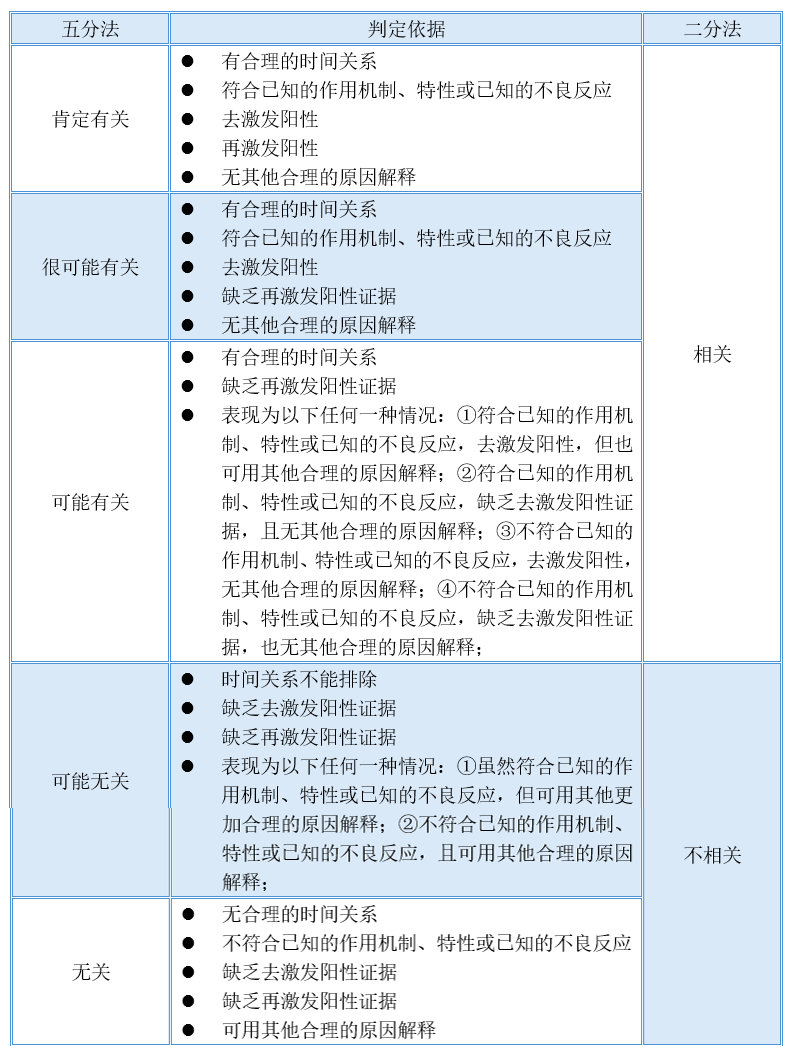
4. 制定了药物临床试验不良事件相关性评价的分类方法和判定依据
专家组综合各种因素考虑及讨论结果,推荐目前药物临床试验中AE相关性评价采用五分法;同时,考虑到部分临床试验的国际性需求及现状,也允许采用二分法;从SUSAR快速报告工作等方面考虑,指导原则中也明确了二分法和五分法在技术上的对应关系。若申请人采用其他的分类方法和判定标准,指导原则中明确“应在临床试验方案中说明其科学合理性依据”。“五分法”和“二分法”判定结果分类及判定依据对照参见下表:
另外,指导原则强调,AE相关性判断应由具备医学专业知识的相关人员做出。
信息来源:
https://www.cde.org.cn/main/news/viewInfoCommon/0a5ae4924881321c07cce100e99f2a5c
(供稿:药物临床试验机构 付康 审阅:陈映霞)